* The preview only shows a few pages of manuals at random. You can get the complete content by filling out the form below.
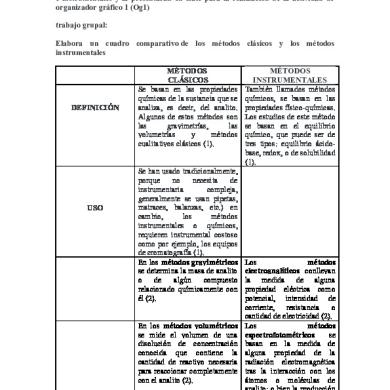
Description
Sandra Chinchilla Sandón Ingeniería Civil Industrial Marzo 2021
Tarea 1 Equilibrar la siguiente ecuación indicando claramente los pasos seguidos
N2H4 + N2O4
N2 + H2
Desarrollo Se utiliza la metodología enseñada para equilibrara la ecuación separando por elementos
a N2H4 + b N2O4 1) 2) 3) 4)
c N 2 + d H2
N: 2a + 2b = 2c H: 4a = 2d O: 4b = d Si damos el valor de a =2
Se puede reemplazar en cada ecuación y obtener: Ejemplo : 4*2 = 2d a 2
d=4 b 1
c 3
d 4
Luego reemplazamos cada índice en la Ecuación, quedando equilibrada de la siguiente manera:
2 N2H4 + N2O4
3N2 + 4 H2
Tarea 2 Reaccionan 6,5 gr de cobre en polvo con 11,2 gr de azufre bajo la siguiente reacción.
16 Cu + S8
8 Cu2S
a) ¿Qué masa en gr se obtiene de Cu2S? b) ¿Cuánto queda sin reaccionar del activo en exceso Como primer paso se debe calcular el reactivo limitante y reactivo en exceso
Cu=6,5 gr de
Cu∗16 mol de Cu =1,64 mol de Cu(reactivo en exceso ) 63,546 gr de Cu
S=11,2 gr de
S∗1 mol de S =0,043 mol de S( reactivolimitante) 256,48 gr de S
a) La masa de Cu2S, se calcula a partir del reactivo limitante
S∗moles de Cu2 S ∗gr de Cu2 S mol de S gr de Cu2 S=moles de moles de Cu2 S S∗8 moles de Cu2 S ∗159,152 gr de Cu2 S 1 mol de S gr de C u 2 S=0,043 mol de =6,8 gr de Cu2 S 8 moles de Cu2 S
b) Cuanto queda sin reaccionar del reactivo en exceso El reactivo en exceso es el Cu, por lo que se realiza el cálculo a partir de :
moles de Cu=moles react . exceso−moles react . limitante moles de Cu=1,64−0,043=1,60 moles gr de Cu que quedan sin reaccionar
gr de Cusin reacc .=¿ moles de gr de Cusin reacc .=¿ 1,60 moles de
Cu∗PM de Cu ¿ moles de Cu
Cu∗63,546 gr de Cu =6,35 gr de Cusin reaccionar ¿ 16 moles de Cu
Tarea 3 Una sal tiene una solubilidad (gr/100ml) T°C 0,5 25, 5,3 80 y 90 100. Calcular: a) Cantidad de agua para disolver 50gr de la sal a 80°C. Para Calcular la cantidad agua se tiene la siguiente formula:
gr de sal∗100 ml solubilidad según temperatura
50 gr de sal∗100 ml =943 ml de H 2 O para disolver 50 gr de sal 5,3 gr b) Cuánta sal precipita al elevar la temperatura de la disolución a 100°C Para levantar la temperatura de disolución a 100 °C, se debe considerar 90 gr
90 gr de sal∗100 ml =9,45 gr sal que presipitara 943 ml de H 2 O
Tarea 4 Hasta obtener 0,5 lt de solución se disolvieron 30 gr de un compuesto cuyo peso molecular es 160(gr/mol), y la densidad es de 1040 (kg/m 3), calcular: a) Concentración de la solución en % masa.
p masa de soluto % = ∗100=¿ p masa de disolución masa de disolución=densidad∗volúmen kg masa de disolución=1040 ∗500 ml=520.000 kg=520 x 10 6 gr ml
( )
p 30 gr de soluto % = x 100=5,7 x 10−6 6 p 520 x 10 gr de disolución
b) Molaridad.
masa n= = PM M=
30 gr de soluto =0,188 mol gr 160 mol
n de moles ¿ de Solución
c) Molalidad.
0,188 mol =0,376 M 0,5 Lts
m=
moles de soluto kg de solvente
Kg de solvente=520.000 kg−0,03 kg=519.999,97 kg m=
0,188 =3,6 x 10−7 molal 519.999,97
d) Fracción molar del soluto y el disolvente
Xsoluto=
mol de soluto ( mol de soluto+mol de solvente )
Xsoluto=
0,188 mol 0,188 mol = =6,5 x 10−6 ( 0,188+ 28.888,8 ) 28.888,98
X solvente=
28.888,8 mol 28.888,8 mol = =0,999 ( 0,188+ 28.888,8 ) 28.889 mol