* The preview only shows a few pages of manuals at random. You can get the complete content by filling out the form below.
Description
Ejercicio 1. Enlace químico, estructuras de Lewis y regla del octeto
Ejercicio 1.1:
Ejercicio 1.2 Tabla 1. Enlace químico, estructuras de Lewis y regla del octeto 1. Nombre del estudiante
Gerson Giovanny Costero Rivera
2. Fórmula química
3. Elementos que conforman la molécula
4. Grupo
oxigeno
Carbonato de potasio K2CO3
5. Periodo
6. Estado de oxidación
7. Electrones de valencia
16
2
-2
2
potasio
1
4
-1 +1
1
carbono
14
2
-4 -2 +2 +4
4
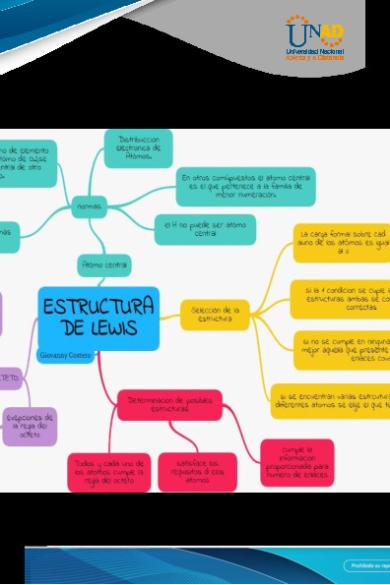
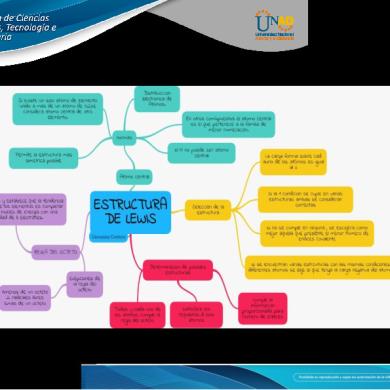
8. Estructura de Lewis
9. Cumple regla del octeto para los elementos que conforman la molécula
10. Tipos de enlaces
SI
Iónico
Ejercicio 2. Geometría molecular Tabla 2. Geometría molecular, electrones enlazantes y libres 1. Nombre del estudiante
Gerson Giovanny Costero Rivera
2. Fórmula
Dióxido de azufre SO2
3. Nomenclatura Tradicional
4. Número total de pares de electrones
5. Número de pares de electrones enlazantes
6. Número de pares de electrones libres
Anhídrido sulfuroso
3
6
12
7. Gráfica distribución de los pares de electrones
8. Nombre de la geometría molecular
trigonal plana
Ejercicio 3. Teoría de enlace de valencia y teoría del orbital molecular Desarrollar pretenden realizar un análisis comparativo entre las teorías de Lewis, orbital molecular y de enlace de valencia; al igual que establecer las características para la configuración de orbitales moleculares en algunas moléculas. Ejercicio 3.1 Elaborar un cuadro comparativo entre los postulados de la teoría de Lewis, teoría de orbital molecular y la teoría de enlace de valencia. El cuadro comparativo debe tener en cuenta los siguientes aspectos: a. Nombre de la teoría de enlace. b. Fecha de postulación de la teoría de enlace. c. Investigadores que propusieron la teoría. d. Principios de cada teoría. e. Electrones que se utilizan para la teoría de enlace. f. Limitaciones de la teoría de enlace g. Propiedades físicas y químicas que se pueden determinar a partir de la teoría de enlace h. Aspectos adicionales que los estudiantes consideren importantes comparar.
Teoría de orbital molecular,Teoría de Lewis, y la Teoría de enlace de valencia. Nombre de la teoría de Fecha de postulación de la teoría de enlace. enlace.
Teoría de orbital molecular
1933
Investigadores que propusieron la teoría.
Principios de cada teoría.
De acuerdo con la teoría de los orbitales moleculares, los enlaces covalentes de las moléculas se forman por solapamiento de orbitales atómicos, de manera que los nuevos orbitales moleculares pertenecen a la molécula entera y no a un solo átomo. Durante la formación de un enlace, los orbitales atómicos se acercan y comienzan a solaparse, liberando energía a medida que el electrón de cada átomo es atraído simultáneamente por la carga positiva del núcleo de los Friedrich Hund, Robert dos átomos. Cuanto mayor sea Mulliken, John C. Slater y el solapamiento, mayor será el John Lennard-Jones. desprendimiento de energía y, por lo tanto, menor será la energía del orbital molecular. Si el proceso de aproximación de los átomos continúa, los núcleos atómicos pueden llegar a repelerse mutuamente, lo que hace que la energía del sistema aumente. Esto significa que la máxima estabilidad (mínima energía) se alcanza cuando los núcleos se encuentran a una distancia determinada que se conoce como longitud de enlace.
Limitaciones de la teoría Electrones que se de enlace utilizan para la teoría de
Este orbital contiene a los dos electrones y mantiene a los dos átomos unidos, por lo que se denomina orbital molecular enlazante. Sin embargo, se forma otro orbital molecular, que posee una energía mayor que la suma de las energías de los dos orbitales atómicos separados. Este orbital molecular se denomina antienlazante y es destructivo, es decir, si los electrones se encontraran en este orbital, los dos átomos se repelerían.
De forma análoga a las limitaciones en el caso de átomos, el principio de exclusión de Pauli limita a dos el número de electrones que pueden ocupar un orbital molecular, lo que obliga a su apareamiento
Propiedades físicas y químicas que se pueden determinar a partir de la teoría de enlace
Los orbitales moleculares s econstruyen habitualmente por combinación lineal de orbitales atómicos centrados en cada átomo de la molécula.El número de orbitales moleculare ses igual al número de orbitales atómicos incluidos en la expansión líneal.Los orbitales atómicos se mezclan más (es decir,contribuyen más a los mismos orbitales moleculares) si tien enenergías similares. Los orbitales atómicos sólo se mezclan si lo permiten las reglas de simetría: Los orbitales que se transforman deacuerdo con diferente srepresentaciones irreducibles del grupo de simetría no se mezclan. Como consecuencia, las contribuciones más importantes provienen de los orbitales atómicos que más solapan (se enlacen).
Aspectos adicionales importantes comparar.
Teoría de enlace de valencia. Concibe el enlace formado por compartición de pares electrónicos localizados entre los átomos enlazados. Implica un solapamiento de los orbitales atómicos Los pares solitarios se localizan sobre átomos concretos Sencilla pero bastante limitada: carece de capacidad predictiva la teoría más moderna del enlace Los Orbitales Moleculares se generan mediante la combinación de Orbitales Atómicos. La ocupación neta de orbitales enlazantes permite justificar la estabilidad de la molécula Los electrones de valencia se sitúan en los OM’s que se distribuyen sobre toda la molécula Resulta complicada cuando aborda moléculas grandes
Teoría de Lewis
1916
Gilbert N. Lewis
Dos átomos se mantienen juntos en un enlace químico al compartir un par de electrones. Cuando cada átomo contribuía con un electrón al enlace, se llamaba enlace covalente. Cuando ambos electrones provienen de uno de los átomos, se denomina enlace covalente dativo o enlace coordinado. La distinción no está muy clara. Por ejemplo, en la formación de un ion amonio a partir de amoníaco e hidrógeno, la molécula de amoníaco dona un par de electrones al protón; la identidad de los electrones se pierde en el ion amonio que se forma. No obstante, Lewis sugirió que un donante de pares de electrones se clasifique como base y un aceptor de pares de electrones se clasifique como ácido.
No explica situaciones como: paramagnetismo del O2 moléculas con electrones desapareados Según esta, una base como NO, iones o sería una especie que radicales puede donar un par de el BF2 es angular electrones, y un ácido la mientras que el BeH2 es que los puede aceptar. Hay átomos que no cumplen con la regla del lineal octeto resonancia El ácido debe tener su modelo esencialmente octeto de electrones incorrecto ya que asume incompleto y la base que cada par de debe tener algún par de electrones electrones solitario. enlazantes se localiza entre los dos atomos unidos. Modelo de enlace Una definición más moderna de localizado un ácido de Lewis es una especie atómica o molecular con un orbital atómico o molecular vacío localizado de baja energía. Este orbital molecular de menor energía (LUMO) puede acomodar un par de electrones.
Teoría de enlace de valencia. Concibe el enlace formado por compartición de pares electrónicos localizados entre los átomos enlazados. Implica un solapamiento de los orbitales atómicos Los pares solitarios se localizan sobre átomos concretos Sencilla pero bastante limitada: carece de capacidad predictiva la teoría más moderna del enlace Los Orbitales Moleculares se generan mediante la combinación de Orbitales Atómicos. La ocupación neta de orbitales enlazantes permite justificar la estabilidad de la molécula Los electrones de valencia se sitúan en los OM’s que se distribuyen sobre toda la molécula Resulta complicada cuando aborda moléculas grandes
La teoría del enlace de valencia se resume en la regla de que el átomo central en una molécula tiende a formar pares de electrones, en concordancia con restricciones geométricas, según está definido por la regla del octeto. La teoría del enlace de valencia está cercanamente relacionada con la teoría de los orbitales moleculares.
Teoría de enlace de valencia.
1927
Walter Heitler Fritz London
Se forma por superposición deorbitales atómicos de Supone que los orbitales dos átomos diferentes, atómicos se solapan en una con un electrón cada uno zona donde se localizan los (orbitales electrones del enlace, para ello semillenos,electronesde es necesario que los átomos sapareados). Al tengan electrones superponerse los dos desapareados. orbitales atómicos se forma un orbital de la La formación del enlace molécula con dos covalente simple tiene lugar electrones, que supone cuando los orbitales la formación de un correspondientes a dos enlace entre los dos electrones desapareados de átomo. átomos diferentes se superponen o solapan, dando lugar a una región común en la cual los dos electrones con espines opuestos, tal y como exige el principio de exclusión de Pauli , ocupan un mismo orbital. Ese par compartido constituye el elemento de enlace entre los dos átomos.
Teoría de enlace de valencia. Concibe el enlace formado por compartición de pares electrónicos localizados entre los átomos enlazados. Implica un solapamiento de los orbitales atómicos La existencia de este par Los pares solitarios se localizan sobre común es lo que átomos concretos determina que los Sencilla pero bastante limitada: núcleos estén ligados Propiedades de aromaticidad en las moléculas que carece de capacidad predictiva entre sí con las la presentan como debidas a la resonancia entre la teoría más moderna del enlace limitaciones que, en las estructuras de Kekulé, Dewar y posiblemente Los Orbitales Moleculares se generan cuanto a iónicas. mediante la combinación de Orbitales proximidad,imponen las Atómicos. La ocupación neta de fuerzas de repulsión orbitales enlazantes permite justificar nuclear. la estabilidad de la molécula Los electrones de valencia se sitúan en los OM’s que se distribuyen sobre toda la molécula Resulta complicada cuando aborda moléculas grandes
Ejercicio 3.2: La siguiente figura representa la configuración de orbitales moleculares para una molécula diatómica.
Con base en lo consultado en las referencias y la interpretación de la figura 1, los estudiantes deben responder las siguientes preguntas de forma individual: 1. ¿Qué se entiende por interferencia destructiva y constructiva y cómo afectan la formación del orbital molecular de enlace y de antienlace? La INTERFERENCIA CONSTRUCTIVA corresponde a la adición de las dos funciones matemáticas (el signo positivo = ondas en fase).
La INTERFERENCIA DESTRUCTIVA corresponde a la sustracción de las dos funciones matemáticas (el signo negativo = ondas en desfase).
Dependiendo de la interferencia que se dé entre los orbitales determinará la formación de los orbitales de enlace o antienlace.
2. ¿Cuáles son los orbitales antienlazantes y enlazantes que presenta la molécula y qué indican cada uno de éstos? El resultado de esta interferencia constructiva es un ORBITAL MOLECULAR ENLAZANTE. Un orbital molecular enlazante tiene menos energía que los orbitales atómicos de los que procede, dando lugar a un enlace entre los átomos. El orbital molecular formado por la sustracción de los 2 orbitales 1 s conduce a una probabilidad electrónica reducida entre los núcleos.
Esto produce un ORBITAL MOLECULAR ANTIENLAZANTE porque produce una densidad electrónica muy baja entre los núcleos. Un orbital molecular antienlazante tiene mayor energía que los orbitales atómicos de los que procede. 3. Explicar cuándo se forma una orbital molecular sigma de enlace, sigma antienlace, pi de enlace y pi antienlace. Tipos de orbitales moleculares: Orbitales tipo σ: el solapamiento se produce preferentemente a lo largo de la línea que une los dos átomos. Orbitales tipo π: el solapamiento se produce preferentemente fuera de la línea que une los dos átomos.
Ejercicio 4. Tipos y fuerzas en el enlace. Ejercicio 4.1 Tabla 3. Tipos de enlace, fuerzas intermoleculares, propiedades físicas y geométricas de moléculas 1. Nombre del estudiante
2. Fórmula del Compuesto
3. Nombre tradicional e IUPAC
4. Tipos de enlaces
Gerson Giovanny Costero Rivera
NaHCO₃
Hidrogenocarbonato de sodio
Enlace iónico
5. Fuerzas intermoleculares
6. Solubilidad en agua
7. Punto de fusión
10,3 g⁄100 g de H2O
323,15 K (50 °C)
8. Geometría molecular
Ejercicio 4.2
Tres elementos P, Q y R tienen números atómicos entre 11 y 18. El átomo P tiene un electrón menos que el gas noble. El átomo Q tiene tres electrones menos que un gas noble. R es un metal del grupo 1. Con base en esta información el grupo debe identificar: a. Cuáles son los elementos P, Q y R b. Tipo de enlace entre R y P, Q y P, P y P c. Fórmula de los compuestos formados. d. Fórmula electrónica de Lewis para cada molécula e. Tipo de fuerzas intermoleculares presentes en cada molécula